記事・インタビュー

はじめに
前回は、輸液の適応3RにおけるResuscitationの輸液、その総論を中心にお話ししました。敗血症での輸液の研究を中心に発展し、Resuscitationの輸液では「ROSD」の4つのフェーズに分けて考えられること、そして、「ROSD」のR:Rescue期をご紹介しました。皆さん、「輸液って奥深いな、面白いな」と感じていただけていますか? この勢いをそのままに、今回はさらに奥が深い、O:Optimization期を取り上げていきますよ!
テーマ予定
シリーズ1. 輸液の適応を3Rで整理する
シリーズ2. 救急外来でのリアルワールド輸液を再考する:Non criticalとCriticalに分類
シリーズ3. Resuscitation:Criticalな患者の輸液総論~“ROSD” 敗血症を例に~
シリーズ4. Resuscitation:敗血症のOptimization phaseをどう乗り切るか?~特に侵襲的モニタリングなし~※今回
シリーズ5. Resuscitation:敗血症のStabilizationやDe-escalation phaseをどうするか?
シリーズ6. Redistribution:あえて代謝性アルカローシスを例に考える
シリーズ7. Redistribution:代謝性アシドーシスを例に考える
シリーズ8. Redistribution:低K血症の補正
シリーズ9. Routine maintenance:Non criticalの急性期維持輸液
シリーズ10. Redistribution:低Na血症の補正を超深掘り
Resuscitation:敗血症のOptimization phaseをどう乗り切るか?:特に侵襲的モニタリングなし
1) Optimization期の極論「輸液必要性があり、輸液反応性があり、輸液耐性があれば、ボーラス輸液をする」「状態が安定していれば、数時間単位で持続輸液の速度をどんどん下げていく」
2) 輸液反応性の判断は時にハードルが高い。心臓に問題がなければ、多少アバウトでも許容されるかも?!
Optimization期はどんなフェーズ?
今回のOptimization期とは、どんなフェーズでしょうか。イメージを大まかにお伝えすると、ERや病棟急変で初期対応が終わって少し状態が改善したくらい、ICUやHCUなどに入室した後から数日の時期というイメージです(図1)。重症の患者のため、多くは中心静脈カテーテルや動脈圧ラインが挿入されていることでしょう。場合によっては気管挿管などもされているかもしれません。この時期は通常、24時間の持続輸液が何かしら投与されていて、カテコラミンなどの循環作動薬をしっかり使っているような状況です。
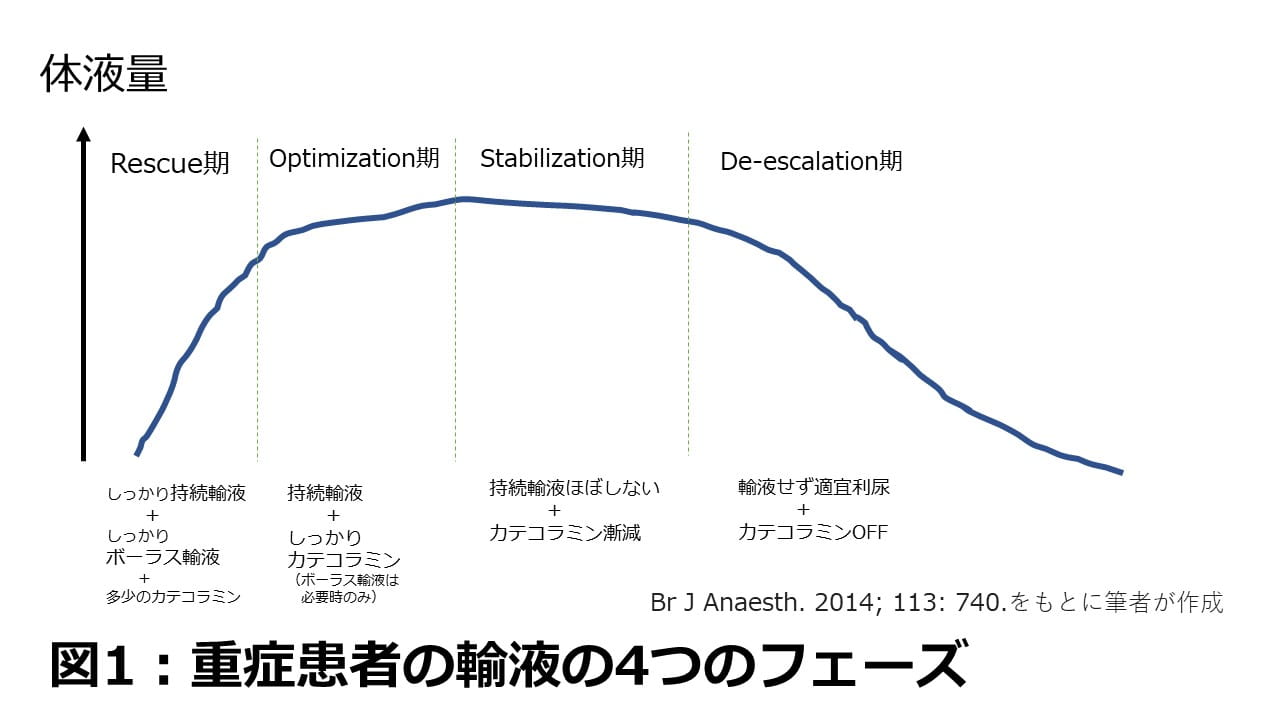 重症患者におけるステージ別の輸液イメージ
重症患者におけるステージ別の輸液イメージ
「じゃあ、ここからは輸液の理論に基づいて維持輸液ですよね。維持輸液だから30ml/kg、だいたい2000ml/日の維持輸液とカテコラミンを使っていればいいのですね?」なんて思っている方、ちょっとお待ちください。実はそうは問屋が卸しません。むしろ、このOptimization期は画一的ではなく、かなり症例によって差が出る、小難しいところ、いや医師の腕の見せ所なのです。Optimizationという英語は最適化という意味です。最も適する形にするには、どんなポイントがあるのか見ていきましょう。
歴史から学ぶOptimization期の難しさ
では、Optimization期の輸液のポイントは…と核心に迫りたいのですが、あえて、その前に、敗血症診療の進歩の歴史を皆さんと共有したいと思います。「え、まどろっこしい!」と思うことなかれ! ストーリーで理解すると、その後の知見の見方が変わってきますし、なぜこういった知見がトレンドなのかを理解することもできるからです。
さて、敗血症は2000年以前の死亡率がとても高かったことで知られています。現在でいうところのOptimization期に循環や細胞への酸素需給バランスを意識した輸液がなされず、漫然とした輸液管理がされていたからと推察します。特に過少輸液、過少介入であったようです。
そのような中、2001年に衝撃の論文がThe New England Journal of Medicine(NEJM)に登場します。Rivers Eらの報告で、最初の6時間以内(Rescue期からOptimization期に相当しますね)に中心静脈圧や平均動脈圧、ScvO2などに目標値を定め、そこがクリアできるように輸液戦略を立て、ゴールを意識した初期治療、Early goal-directed therapy(EGDT)を行うことで、敗血症性ショックの院内死亡率が46.5%から30.5%に下がったというものです1)。
46.5%から30.5%への劇的な低下、NNT:6という驚異的な数字は、当時とても注目されました。ここから、「輸液も含めてエビデンスに基づく敗血症診療を!」という流れが加速し、2004年には、Surviving guidelines for management of sepsis and septic shock:SSCGという世界的なガイドラインが出て2)、以後、定期的な改定が加えられていることは皆さんご存知の通りです。
しかし、EGDTに準じたRescue期からOptimization期相当の輸液戦略のおかげで、敗血症の死亡率がどんどん下がって万々歳…とはなりませんでした。このガイドラインが出て約10年が経過したころから、「本当にEGDTに効果があるかは懐疑的」という研究結果が立て続けに出て、「EGDTは恩恵がない」というメタ解析すら出たのです3)。
特にEGDTに準じた輸液戦略を取ることで、輸液過多が増え、胸腔穿刺や利尿薬の使用率と院内死亡率の上昇に関連することがわかりました4)。過少輸液の反動で、過剰輸液の歴史になったというのは皮肉なものですね。一方で、過去の偉人たちもOptimization期の輸液で、様々な苦労や失敗を重ねてきたとも言えます。それだけOptimization期の輸液が一筋縄ではいかないということですね。
そんな「過剰輸液が害」だとわかりだした2010年前後くらいから、輸液をすることで循環がどのように反応するか、輸液反応性(fluid responsiveness)の研究が進みだしました5)。現在はさらに、どんな時に輸液が必要かの輸液必要性(循環不全、hypoperfusionとほぼ同義)、どんな時に輸液をすると、かえって害になるか、どんな時なら輸液に耐えられるかといった輸液耐性(fluid tolerance)への理解につながっていきます。歴史の失敗を経て出てきた、輸液必要性、輸液反応性、輸液耐性。現在はこの3つを考慮しながら、メリハリのある輸液をすることがトレンドになっています。
Optimization期で輸液反応性は大事…、だけど…
Optimization期の輸液は、極論すると「輸液必要性があり、輸液反応性があり、輸液耐性があれば、ボーラス輸液をする」「状態が安定していれば、数時間単位で持続輸液の速度をどんどん下げていく」という、「輸液を入れるときにはガツンと1回入れる」「安定していれば輸液を絞りだす」という超メリハリをつけた戦略が現在のトレンドです。
では、重要なキーワードである輸液必要性、輸液反応性、輸液耐性を、それぞれどのように判断したらよいでしょうか。これらを学術的に厳格に定義することはかなり難しく、実は今も議論がある領域です。ただ、それでは現場に実装できないので、筆者個人としては以下のように臨床的判断をしています(表1)。

この輸液反応性の判断が、リアルワールドでは時にネックになり、悩みの種です。というのも、1回拍出量や心拍出量を測定するという難しさや、陽圧換気をしているなどの条件の厳しさがあるためです。挿管してICU管理し、1回拍出量や心拍出量を気軽に測定するデバイス(スワンガンツカテーテルや、フロートラックなどのarterial pressure-based cardiac output: APCOなど)が自由に挿入できるICUやHCUであれば、もちろん問題ないでしょう。
一方で、小規模病院などでは「うちでは、スワンガンツカテーテルは入れられません、フロートラック®は取り扱っていません。挿管するハードルが高いです」ということもありえるでしょう。実際、敗血症は高齢者の増加に伴って頻度が増えている疾患です6)。高齢者の多い地方の病院や小~中規模の病院こそ、敗血症の管理の必要性が増していますが、そのような病院で最新のデバイスが使えないというジレンマは往々にして生じがちです。(筆者も地方の小規模病院に勤務した経験があるので、そのジレンマは痛いほどわかります)エコーはほとんどの病院で置いているでしょうが、一方で、心拍出量や1回拍出量の変化をベッドサイドで気軽に測定できるかというと、ハードルが高いと感じる医師が多いでしょう。そのため、この記事では、あえて、「侵襲的モニタリングが十分にない」状況でのOptimization期の輸液戦略にチャレンジしてみます。
筆者の考える侵襲的モニタリングがない状況でのOptimization期の輸液戦略
では、侵襲的モニタリングがない状況でのOptimization期で、筆者は輸液をどのようにしているか、ご紹介します(図2)。
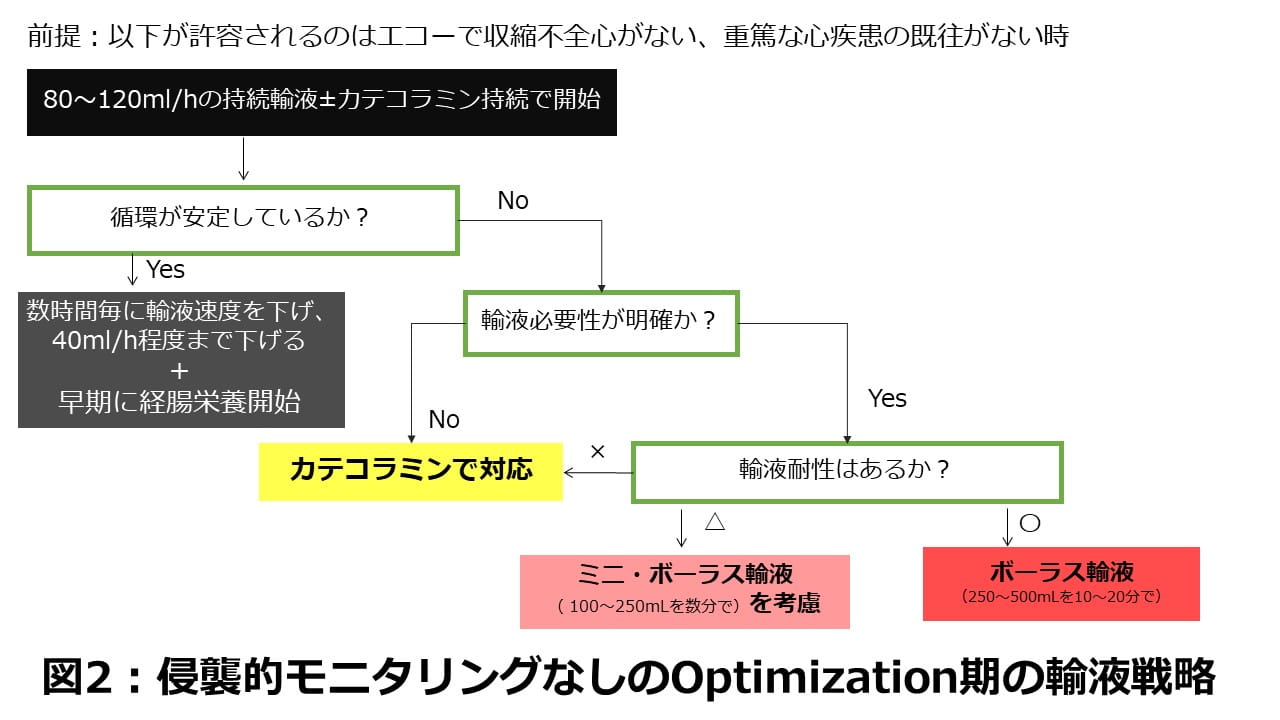
特にそのポイントをお伝えしますと、
①前提として、適切な輸液量には「絶対的な点」ではなく、「許容できる幅」があります。その許容できる幅がある程度広いケースでは、侵襲的モニタリングを使って厳密な輸液反応性を毎回確認しないことも許容されるだろうと考えられます。その許容できる幅がある程度広いケースとは、心臓に大きな問題がないケースです。逆にいえば、心臓に問題があるケースでは侵襲的モニタリングを挿入し、輸液反応性をしっかり確認しながらの輸液が必要です。
②ひとまずの循環の安定として、ほとんどのケースで平均動脈圧(MAP)>65mmHgを目指します。基礎疾患によって目標とするMAPを変えるべきかどうかは議論があります。筆者は高血圧がある患者で、最初の数時間で尿量が乏尿の患者では、収縮不全心がなければ、MAP>80mmHgと高めに管理しています。これはSEPSISPAM trialのサブ解析で、高めのMAP目標値で急性腎障害(AKI)の導入を減らす可能性が示唆されているためです7)。
③輸液制限のStudy: CLOVERS trial8)を参考にして、Optimization期は24時間で1000~1500ml程度になるように、どんどん輸液を絞ることを筆者は原則としています。
④輸液必要性はCLASSIC trial9)を基に、表1にあるような動脈ガスでLac>4mmol/L, を使ってもMAP<50mmHg、Mottlingが強いかなど、簡便な指標で筆者は判断しています。
⑤輸液耐性も簡便であるため大事にしています。エコーで肺エコーやVExUSなどの評価も大事にしていますし、さらに簡便なものではin/outバランスが2L以上は目安かもしれません。積極的利尿を検討した研究RADAR-2 trial10)を踏まえ、このin/outバランスが2L以上をなるべく超えないように筆者は管理しています。
終わりに
今回はOptimization期の輸液の難しさと、実際の現場でどう対応するかをお伝えいたしました。いかがだったでしょうか?特に筆者の私見を交えた、「侵襲的モニタリングがない状況でのOptimization期の輸液戦略」は、厳密性に欠ける点もあるため、当然、その内容には議論の余地があるところです。ただ、ほぼどのような病院でも現場に実装できるような形を意識して戦略を立てており、使い勝手はよいと自負しています。 皆さんのお役に立つことができれば幸いです。そして、次回は輸液のStabilization期やDe-escalation 期を深掘りしていきます。次回もお楽しみに!
<参考文献>
1)Rivers E, Nguyen B, Havstad S, Ressler J, Muzzin A, Knoblich B, et al. Early goal-directed therapy in the treatment of severe sepsis and septic shock. N Engl J Med. 2001 Nov;345(19):1368–77.
2)Dellinger RP, Carlet JM, Masur H, Gerlach H, Calandra T, Cohen J, et al. Surviving Sepsis Campaign guidelines for management of severe sepsis and septic shock. Crit Care Med. 2004 Mar;32(3):858–73.
3)Angus DC, Barnato AE, Bell D, Bellomo R, Chong CR, Coats TJ, et al. A systematic review and meta-analysis of early goal-directed therapy for septic shock: the ARISE, ProCESS and ProMISe Investigators. Intensive Care Med. 2015 Sep;41(9):1549–60.
4)Kelm DJ, Perrin JT, Cartin-Ceba R, Gajic O, Schenck L, Kennedy CC. Fluid overload in patients with severe sepsis and septic shock treated with early goal-directed therapy is associated with increased acute need for fluid-related medical interventions and hospital death. Shock Augusta Ga. 2015 Jan;43(1):68–73.
5)Marik PE, Monnet X, Teboul JL. Hemodynamic parameters to guide fluid therapy. Ann Intensive Care. 2011 Mar;1(1):1.
6)Girard TD, Opal SM, Ely EW. Insights into severe sepsis in older patients: from epidemiology to evidence-based management. Clin Infect Dis Off Publ Infect Dis Soc Am. 2005 Mar;40(5):719–27.
7)Asfar P, Meziani F, Hamel JF, Grelon F, Megarbane B, Anguel N, et al. High versus low blood-pressure target in patients with septic shock. N Engl J Med. 2014 Apr;370(17):1583–93.
8)The National Heart, Lung, and Blood Institute Prevention and Early Treatment of Acute Lung Injury Clinical Trials Network. Early Restrictive or Liberal Fluid Management for Sepsis-Induced Hypotension. N Engl J Med. 2023 Feb ;388(6):499–510.
9)Meyhoff TS, Hjortrup PB, Wetterslev J, Sivapalan P, Laake JH, Cronhjort M, et al. Restriction of Intravenous Fluid in ICU Patients with Septic Shock. N Engl J Med. 2022 Jun;386(26):2459–70.
10)Silversides JA, McMullan R, Emerson LM, Bradbury I, Bannard-Smith J, Szakmany T, et al. Feasibility of conservative fluid administration and deresuscitation compared with usual care in critical illness: the Role of Active Deresuscitation After Resuscitation-2 (RADAR-2) randomised clinical trial. Intensive Care Med. 2022 Feb;48(2):190–200.
<プロフィール>

柴﨑 俊一(しばざき・しゅんいち)
ひたちなか総合病院 総合内科
2010年、筑波大学医学専門学群医学類を卒業。諏訪中央病院にて初期研修を経て、2012年に同病院内科研修医。
その後、名古屋第二赤十字病院腎臓内科にて国内留学、諏訪中央病院にて腎臓・糖尿病内科/総合内科として勤務後に2017年から現職。
個人としては”日本の墨子”を目指し、組織としては、茨城1愛ある診療を目標にかかげる。市中病院改革:特に教育改革、ボトムアップ型組織マネジメントを進めている。
柴﨑 俊一
このシリーズの記事一覧
-
記事

3Rで整理する 輸液の基本の「き」 ~輸液の適応を3Rで整理する~
- 研修医
- 専攻医・専門医
3Rで整理する 輸液の基本の「き」 ~輸液の適応を3Rで整理する~
柴﨑 俊一
-
記事

3Rで整理する 輸液の基本の「き」 ~救急外来でのリアルワールド輸液を再考する:Non criticalとCriticalに場合分け~
- 研修医
- 専攻医・専門医
3Rで整理する 輸液の基本の「き」 ~救急外来でのリアルワールド輸液を再考する:Non criticalとCriticalに場合分け~
柴﨑 俊一
-
記事
3Rで整理する 輸液の基本の「き」 ~Resuscitation:Criticalな患者の輸液総論:“ROSD” 敗血症を例に~
- 研修医
- 専攻医・専門医
3Rで整理する 輸液の基本の「き」 ~Resuscitation:Criticalな患者の輸液総論:“ROSD” 敗血症を例に~
柴﨑 俊一
関連する記事・インタビュー
-
記事

3Rで整理する 輸液の基本の「き」 ~Resuscitation:Criticalな患者の輸液総論:“ROSD” 敗血症を例に~
- 研修医
- 専攻医・専門医
3Rで整理する 輸液の基本の「き」 ~Resuscitation:Criticalな患者の輸液総論:“ROSD” 敗血症を例に~
柴﨑 俊一
-
記事

3Rで整理する 輸液の基本の「き」 ~Resuscitation:敗血症のStabilization期やDe-escalation期をどうするか?~
- 研修医
- 専攻医・専門医
3Rで整理する 輸液の基本の「き」 ~Resuscitation:敗血症のStabilization期やDe-escalation期をどうするか?~
柴﨑 俊一
-
記事

3Rで整理する 輸液の基本の「き」 ~救急外来でのリアルワールド輸液を再考する:Non criticalとCriticalに場合分け~
- 研修医
- 専攻医・専門医
3Rで整理する 輸液の基本の「き」 ~救急外来でのリアルワールド輸液を再考する:Non criticalとCriticalに場合分け~
柴﨑 俊一
-
記事

3Rで整理する 輸液の基本の「き」 ~Redistribution:あえて代謝性アルカローシスを例に考える~
- 研修医
- 専攻医・専門医
3Rで整理する 輸液の基本の「き」 ~Redistribution:あえて代謝性アルカローシスを例に考える~
柴﨑 俊一
人気記事ランキング
-

医師が後回しにしがちな、もったいない控除枠3選!
- ライフスタイル
- 専攻医・専門医
- お金
医師が後回しにしがちな、もったいない控除枠3選!
-

著者が語る☆書籍紹介 『がっくんといっしょ エコー解剖のひろば』
- 新刊
- 研修医
- 医書マニア
著者が語る☆書籍紹介 『がっくんといっしょ エコー解剖のひろば』
石田 岳
-

書評『臨床推論の落とし穴 ミミッカーを探せ!』~“ミミッカー”の視点で臨床推論を深める一冊!
- 新刊
- 研修医
- 医書マニア
書評『臨床推論の落とし穴 ミミッカーを探せ!』~“ミミッカー”の視点で臨床推論を深める一冊!
三谷 雄己【踊る救急医】
-

整形外科に進まない研修医も必読!研修医が読んでおくべき整形外科系の医学書4選
- ベストセラー
- 研修医
- 医書マニア
整形外科に進まない研修医も必読!研修医が読んでおくべき整形外科系の医学書4選
三谷 雄己【踊る救急医】
-

書評『あの研修医はすごい! と思わせる 症例プレゼン〜ニーズに合わせた「伝わる」プレゼンテーション』
- 新刊
- 研修医
- 医書マニア
書評『あの研修医はすごい! と思わせる 症例プレゼン〜ニーズに合わせた「伝わる」プレゼンテーション』
三谷 雄己【踊る救急医】
-

著者が語る☆書籍紹介 『暗記しやすい! 医療現場の言いかえ英単語』
- 新刊
- 研修医
- 医書マニア
著者が語る☆書籍紹介 『暗記しやすい! 医療現場の言いかえ英単語』
山田 悠史
-
研修医や専攻医などの若手医師でも、医師賠償責任保険は必要?
- 研修医
- ライフスタイル
- お金
研修医や専攻医などの若手医師でも、医師賠償責任保険は必要?
-

著者が語る☆書籍紹介 『胸部X線・CTの読み方やさしくやさしく教えます!改訂版』
- 新刊
- 研修医
- 医書マニア
著者が語る☆書籍紹介 『胸部X線・CTの読み方やさしくやさしく教えます!改訂版』
中島 啓
-

2025年最新版 初期研修医におすすめの救急を学べる医学書10選
- ベストセラー
- 研修医
- 医書マニア
2025年最新版 初期研修医におすすめの救急を学べる医学書10選
三谷 雄己【踊る救急医】
-

医師が選ぶならどんな保険?お得な保険の選び方
- ライフスタイル
- 開業
- お金
医師が選ぶならどんな保険?お得な保険の選び方
